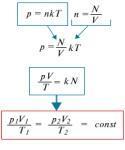
Шановні студенти!
Нижче для вас розміщено методичні матеріали з головних курсів, що викладаються кафедрою хімії та методики її навчання. Ласкаво просимо переглянути їх і сподіваємось, що ці матеріали зроблять ваш нелегкий шлях до знань більш зручним та ефективним. Для перегляду матеріалів на тисніть будь-ласка на назву потрібного Вам розділу і перейдіть за посиланням.
З повагою кафедра хімії та методики її навчання Криворізького державного педагогічного університету
- Автор: Кафедра хімії і безпеки життєдіяльності
- Перегляди: 1927
Шановні студенти магістратури спеціальності 014.06 Середня освіта (Хімія)!
Вашій увазі представлено:
- Автор: Кафедра хімії і безпеки життєдіяльності
- Перегляди: 1647
Шановні студенти магістратури спеціальності Середня освіта (Біологія та здоров'я людини)!
Для вашої повноцінної та якісної підготовки до комплексного кваліфікаційного екзамену з хімії та методики навчання хімії кафедра хімії та методики її навчання КДПУ розміщує програму комплексного кваліфікаційного екзамену для студентів спеціальності 014.05 Середня освіта (Біологія та здоров'я людини)!
Нагадуємо, що успішне проходження цього комплексного кваліфікаційного екзамену є необхідною умовою для отримання диплому магістра зі спеціальності 014.05 Середня освіта (Біологія та здоров'я людини) з додатковою спеціальністю Середня освіта (Хімія).
Щиро бажаємо вам успіху!
- Автор: Кафедра хімії і безпеки життєдіяльності
- Перегляди: 1590
Шановні випускники бакалаврату!
Для забезпечення можливості підготовки студентів до комплексного екзамену з хімії та методики її навчання у межах підсумкової атестації здобувачів вищої освіти кафедра хімії і безпеки життєдіяльності КДПУ розміщує у цьому матеріалі програми відповідних атестацій.
Щиро бажаємо вам успіху!
- Автор: Кафедра хімії і безпеки життєдіяльності
- Перегляди: 2000